W naszej pracy badamy, w jaki sposób białka wiążące RNA (RBPs) regulują aktywność genów oraz wspierają układ odpornościowy w walce z wirusami RNA. Wykorzystując zaawansowane techniki biologii strukturalnej oraz eksperymenty na żywych komórkach, odkryliśmy RBPs oraz drobnocząsteczkowe związki wpływające na produkcję kluczowego białka związanego z chorobą Parkinsona. Ponadto zidentyfikowaliśmy nowe białko RBP odgrywające istotną rolę w odpowiedzi immunologicznej na infekcje wirusowe. Nasze badania odpowiadają na fundamentalne pytania z zakresu biologii molekularnej i otwierają nowe możliwości terapii zarówno chorób zakaźnych, jak i niezakaźnych.
Podsumowanie badań
RNA to cząsteczka niezbędna do życia – przenosi informacje genetyczne z DNA do procesu syntezy białek, pełniąc przy tym kluczowe funkcje regulacyjne i katalityczne. Jedna z wiodących hipotez zakłada, że życie mogło rozpocząć się w tzw. świecie RNA, poprzedzającym pojawienie się DNA. Do prawidłowego działania RNA potrzebuje jednak białek wiążących RNA (RBPs), które odpowiadają za jego przetwarzanie, transport i translację, wspierając tym samym przepływ informacji genetycznej oraz prawidłowe funkcjonowanie komórek. Interakcje RNA–białko stanowią także podstawę mechanizmów odpornościowych – niektóre RBPs rozpoznają RNA wirusowe i aktywują odpowiedź immunologiczną. Zakłócenia tych interakcji przyczyniają się do rozwoju chorób, w tym unikania odporności przez wirusy i chorób neurodegeneracyjnych, takich jak choroba Parkinsona (PD).
W Centrum Dioscuri Oddziaływań RNA-Białko w Zdrowiu i Chorobie Człowieka w Międzynarodowym Instytucie Biologii Molekularnej i Komórkowej w Warszawie badamy, jak te interakcje wpływają na systemy komórkowe. Nasze badania koncentrują się na dwóch głównych obszarach: 1) jak RBPs umożliwiają wykrywanie wirusowego i terapeutycznego RNA przez układ odpornościowy oraz 2) jak ukierunkowanie interakcji RNA-białko może pomóc w leczeniu chorób człowieka, zwłaszcza infekcji wirusowych i PD.
Badamy, w jaki sposób RBPs rozpoznają charakterystyczne cechy RNA wirusowego i uruchamiają odpowiedź immunologiczną, m.in. poprzez indukcję interferonów. Zrozumienie tych procesów może przyczynić się do opracowania nowych leków przeciwwirusowych lub szczepionek. W kontekście choroby Parkinsona koncentrujemy się na regulacji ekspresji alfa-synukleiny przez RBPs oraz mikroRNA. Naszym celem jest modulacja tych interakcji w celu przywrócenia prawidłowej równowagi molekularnej i spowolnienia postępu choroby.
Wpływ naukowy
- Pogłębienie wiedzy na temat interakcji RNA–białko jako kluczowych regulatorów odporności wrodzonej, co może umożliwić opracowanie innowacyjnych strategii przeciwwirusowych.
- Zidentyfikowanie mechanizmów molekularnych leżących u podstaw choroby Parkinsona oraz wyznaczenie nowych celów terapeutycznych.
Plany badawcze
Planujemy kontynuować interdyscyplinarne badania nad powiązaniami biologii RNA z chorobami człowieka. Zamierzamy pogłębić analizę udziału RBPs w szlakach sygnalizacji wirusowej, co może doprowadzić do rozwoju szerokiego wachlarza nowych terapii przeciwwirusowych. Równocześnie będziemy poszerzać wiedzę o szlakach regulacyjnych RNA i poszukiwać związków chemicznych zdolnych do obniżania poziomu alfa-synukleiny w celu opracowania strategii terapeutycznych dla choroby Parkinsona.
Współprace
- Z prof. Jurim Rappsilberem (Technische Universität Berlin) prowadzimy analizy całych proteomów oraz badania strukturalne z wykorzystaniem spektrometrii mas.
- Z prof. Andrzejem Dziembowskim (IIMCB) i prof. Guntherem Hartmannem (Bonn Medical University) badamy immunogenność terapeutycznych RNA.
- Z dr hab. Elżbietą Nowak (IIMCB) i prof. Marcinem Nowotnym (IIMCB) analizujemy struktury białek RBPs.
- Z dr Katarzyną Mleczko-Sanecką (IIMCB), dr hab. Wojciechem Pokrzywą (IIMCB) oraz prof. Tilo Kunathem (University of Edinburgh) badamy działanie związków oddziałujących na RBPs w warunkach komórkowych i organizmalnych.
Komentarz
„W moich badaniach odkrywam złożone powiązania między biologią RNA a chorobami człowieka, dążąc do stworzenia innowacyjnych terapii nowej generacji” – mówi prof. Gracjan Michlewski.
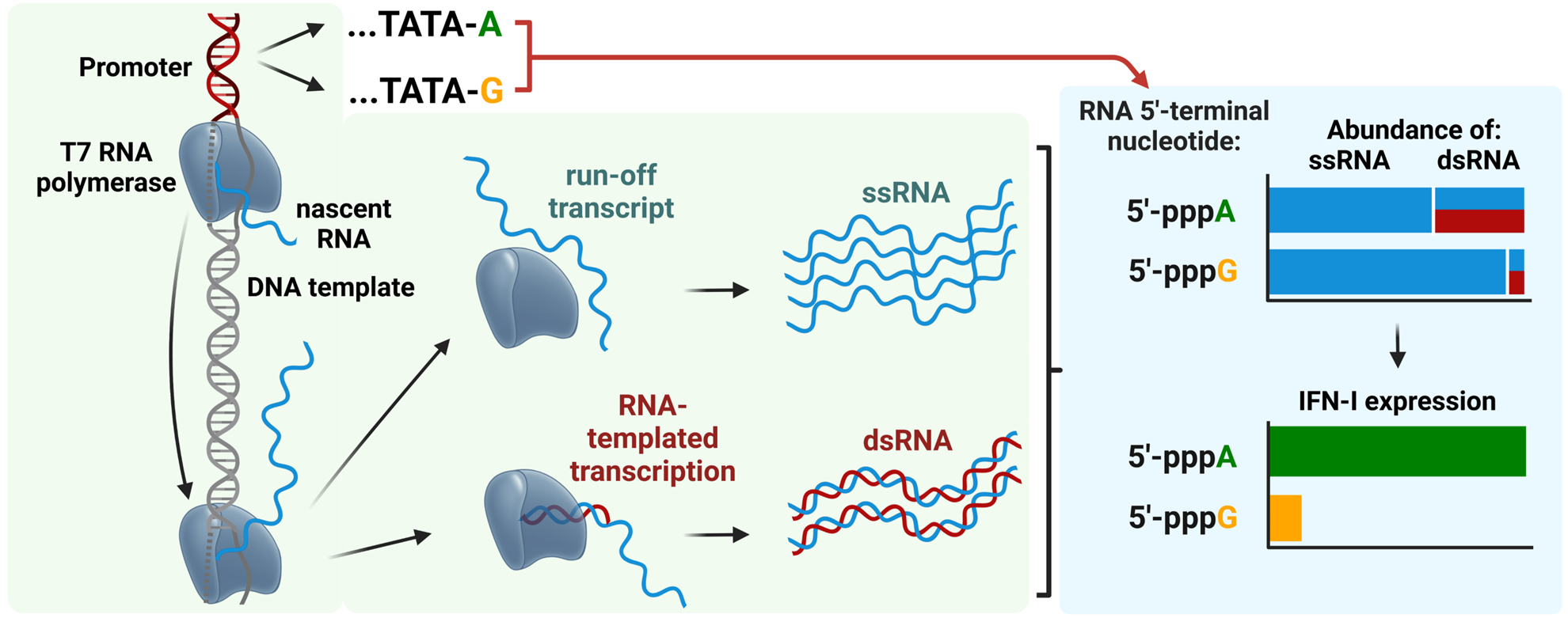
RNA wytworzone metodą transkrypcji in vitro z końcowym nukleotydem 5′-pppA są bardziej immunogenne niż te z 5′-pppG, ze względu na wyższy poziom dwuniciowego RNA (dsRNA), który silnie aktywuje szlak RIG-I/interferonu typu I [Źródło: https://doi.org/10.1093/nar/gkae1252]